近日,复旦大学附属华山医院运动医学科华英汇教授团队在关节疾病研究领域取得重要进展,研究成果以《解析痛风石与滑膜组织:SPP1阳性巨噬细胞驱动关节组织细胞外基质重塑》(Deconstruction of tophi and synovium defines SPP1⁺
macrophages involved in extracellular matrix remodeling in gout)为题,于风湿病学国际权威期刊《风湿病学年鉴》(Annals of the Rheumatic Diseases)(2024年影响因子20.6)正式在线发表。该研究首次系统解析了痛风石(tophi)及痛风间期滑膜组织的单细胞及空间转录组特征,揭示了SPP1高表达巨噬细胞在细胞外基质(ECM)重塑中的关键作用,为理解痛风慢性病变机制提供了全新视角。
值得一提的是,这是该团队近3年在《风湿病学年鉴》上发表的第3篇原创性研究成果。此外,团队作为主导已在痛风领域累计发表影响因子10以上的期刊论文7篇,标志着其在慢性痛风性关节炎的临床诊疗与疾病机制研究方面已跻身国际前列。

痛风是一种由高尿酸血症引起的常见代谢性关节炎。尽管其急性发作机制已较为明确,但慢性阶段尤其是痛风石的形成机制仍不清晰。痛风石作为痛风的晚期表现,结构复杂,涉及先天性与适应性免疫系统的激活以及细胞外基质的异常重塑,其微环境中免疫细胞与基质细胞之间的相互作用机制尚待深入揭示。
该研究整合单细胞转录组测序(scRNA-seq)与空间转录组学(ST)技术,对痛风石及滑膜组织进行了高分辨率解析。研究发现,在痛风石特有的冠状区(corona zone)内存在一个以往研究未曾报道的巨噬细胞亚群,该亚群特征性高表达SPP1、MMP9和CHI3L1,被命名为“痛风石相关巨噬细胞”(tophaceous gout-associated macrophages, TGAMs)。TGAMs在痛风石中显著富集,提示其与痛风石形成密切相关。
TGAMs表现出双重功能特性:一方面高表达免疫调节相关基因,参与炎症反应;另一方面显著上调ECM调控基因(如MMP9、COL6A2),展现出强烈的基质降解与组织重塑能力,并具备向破骨细胞分化的潜能。进一步分析发现,TGAMs共表达成纤维细胞标志物S100A4,提示可能存在巨噬细胞-成纤维细胞转分化(MFT)现象,这可能在痛风石的ECM重构中发挥关键作用。
此外,细胞通讯分析显示,TGAMs通过整合素介导的相互作用(特别是SPP1-CD44受体-配体对)与周围的成纤维细胞、破骨细胞及调节性T细胞(Tregs)形成紧密交流网络,构建了一个连接慢性炎症与组织破坏的致病轴。研究还发现,成纤维细胞和成骨细胞在痛风石中表现出由促炎表型向ECM调控表型的转变,共同参与痛风石的结构稳定与骨侵蚀过程。
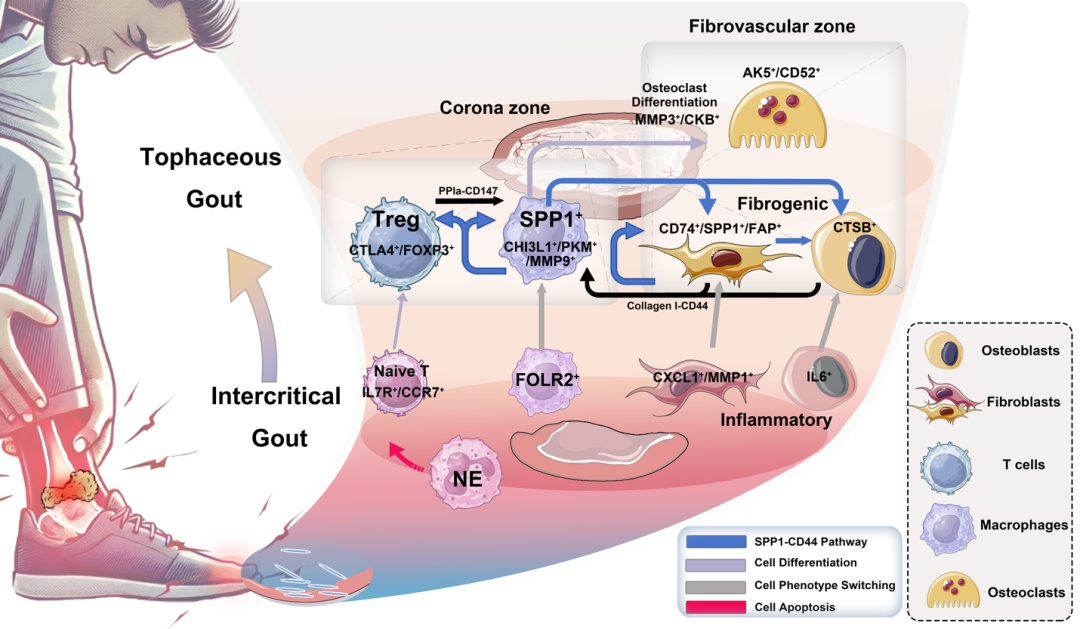
该研究首次在单细胞和空间层面系统描绘了痛风石的转录组特征,发现并鉴定了一个新的巨噬细胞亚群TGAMs,揭示了其在ECM重塑与慢性炎症耦合中的核心作用。这些发现不仅深化了对痛风石形成机制的理解,也为延缓甚至逆转痛风石进展提供了潜在治疗靶点,具有重要的科学价值与临床转化前景。
复旦大学附属华山医院运动医学科徐翰林博士、刘哲辰博士和周晓锋博士为论文共同第一作者;复旦大学附属华山医院运动医学科华英汇教授,国家老年疾病临床医学研究中心(华山)双聘专家、复旦大学免疫学系何睿教授,复旦大学附属华山医院客座教授、奥克兰大学Nicola Dalbeth教授,复旦大学附属华山医院运动医学科徐翰林博士为共同通讯作者。复旦大学附属华山医院运动医学科纪晓希医生、刘兴旺医生、风湿科朱小霞教授,以及香港大学病理学系吕力为教授亦对本研究作出重要贡献。复旦大学附属华山医院为通讯单位。该研究受上海市基础研究计划“自然科学基金”青年项目(项目号: 25ZR1402050)、上海市白玉兰人才计划浦江项目(项目号: 24PJD009),上海市“超级博士后”激励计划(项目号: 2024097)、国家资助博士后研究人员计划(项目号: GZC20240290)中国博士后科学基金面上资助项目(项目号:2025M772323)的资助。
原文链接:https://doi.org/10.1016/j.ard.2025.09.003
文丨运动医学科 徐翰林
审核丨运动医学科 华英汇
喜欢就奖励一个“”和“❤”呗